Loi de Henri
![]()
DISSOLUTION DES GAZ 
I NOTION DE DISSOLUTION
Certains corps peuvent en absorber d'autres qui sont alors dissout.
Quand vous ouvrez une bouteille de boisson gazeuse, il y a un dégagement de bulles qui prouvent la présence de gaz dans la boisson. Ce gaz est à une pression supérieure à la pression du même gaz dans le milieu ambiant. Les gaz sont donc solubles dans les liquides en fonction de leur coefficient de solubilité dans le liquide.
II CARACTÉRISTIQUES DE LA DISSOLUTION DES GAZ DANS LES LIQUIDES
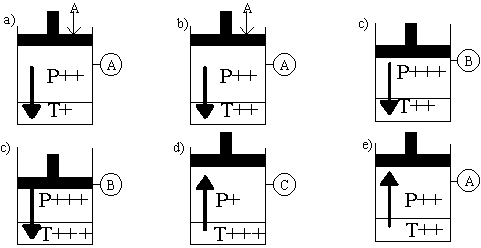
1) Expérience :
a) Considérons une cuve contenant un liquide quelconque et fermée par un piston. La cuve est équipée d'un manomètre qui permettra de mesurer la pression exercée sur le gaz. On exerce une pression A.
Sous l'effet de la pression, le piston s'enfonce et quand le manomètre indique A , il s'arrête.
b) Au bout de quelques heures, le piston est descendu plus bas et le manomètre indique toujours la pression A.
Le piston s'immobilise définitivement.
La pression est toujours de A. Au départ, le gaz s'est comprimé à la pression A. Les liquides sont incompressibles mais si le piston a continué à descendre, c'est que la quantité de gaz au-dessus du liquide a diminué (Loi de Mariotte). Cette quantité de gaz manquante s'est donc solubilisée dans le liquide.
Quand le piston finit par s'immobiliser définitivement, il y a équilibre entre la pression du gaz au-dessus du liquide et la pression du gaz dissout dans le liquide.
Cette pression est égale à A.
c) Nous augmentons la pression à une pression B et nous constatons le même phénomène. Donc en augmentant la pression du gaz sur le liquide, nous avons fait entrer une quantité supplémentaire de gaz dans le liquide.
d) Si nous faisons l'expérience inverse, nous observons que le manomètre indique une valeur C inférieure à A.
e) Au bout d'un certain temps, le piston étant toujours immobile, la pression indiquée par le manomètre remonte lentement pour se fixer sur la valeur A.
Nous sommes à nouveau dans un état d'équilibre.
2) Conclusion :
- Pression = pression exercée sur le gaz
- Tension = pression du gaz dissout dans le liquide
- - La dissolution d'un gaz dans un liquide n'est pas instantanée.
- - Si la pression augmente, la tension augmente progressivement.
- - Si la pression diminue, la tension diminue progressivement
- - On arrive au bout d'un certain temps, à une équilibre où la tension est devenue égale à la pression
- - Cet état de saturation est différent suivant la pression et varie dans le même sens que la pression.
D'où l'énoncé de la LOI DE HENRY : A température constante et à saturation, la quantité de gaz dissoute dans un liquide est proportionnelle à la pression de ce gaz au dessus de ce liquide.
- Q = K * P Q = quantité de gaz dissout
- K = Coefficient de solubilité
- P = Pression au dessus du liquide
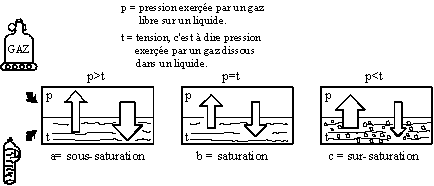
III LES DIFFÉRENTS ÉTATS DE SATURATION
La quantité de gaz qu'un volume donné de liquide peut absorber dépend essentiellement de la Pression Absolue exercée par le gaz sur le liquide.
|
Pression |
P augmente |
P fixe |
P diminue |
P diminue |
P diminue |
||||
|
|
|
|
|
|
||||
|
|
|
|
|
|
||||
la saturation :
État où la pression du gaz au-dessus du liquide est égale à la tension du gaz dissout
État stable qui n'évolue pas
| P = T |
la sous saturation :
État où la pression au-dessus du liquide est supérieure à la tension du gaz dissout. Le liquide va recommencer à dissoudre du gaz pour tendre vers un nouvel état de saturation.
État instable qui évolue vers la saturation
| P > T |
la Sursaturation :
État où la pression du gaz dissout est supérieure à la pression du gaz libre. Le liquide va éliminer du gaz pour tendre vers un nouvel état de saturation.
État instable qui évolue vers la saturation
| P < T |
la Sursaturation critique:
La différence entre la pression du gaz et la quantité de gaz dissout dans le liquide est trop importante. Non seulement le gaz dissout s'échappe du liquide, mais en plus , il se dégage sous forme de bulles au sein de ce liquide et ce sont ces bulles qui, entraînées dans la circulation sanguine vont provoquer les accidents de décompression.
| P >> T |
Au delà de la sursaturation critique => dégazage incontrôlé
- La sursaturation est un état instable. Il existe une valeur limite au rapport Tension du gaz dissout sur Pression des gaz au-dessus du liquide, c'est le rapport SC de sursaturation critique.
- C'est le rapport au-delà duquel le gaz dissout dans le liquide va s'échapper en formant des bulles libres
- ==> désaturation explosive.
- SC = tension des gaz dissout
- pression ambiante
IV FACTEURS INFLUANT SUR LA DISSOLUTION
La dissolution = Absorption d'un gaz ou d'un solide par un liquide
 |
Loi de Henry :A température constante et à saturation, la quantité de gaz dissoute dans un volume donné de liquide est proportionnelle à la pression de ce gaz au dessus de ce liquide.Dans le vide, le gaz a une expansion infinie. Expansion est liée à la pression du milieu dans lequel le gaz tente de pénétrer. Plus le coefficient de solubilité est élevé et plus la quantité de gaz dissout sera importante à pression égale. |
la pression dépend de
la nature du gaz et du liquide :
- Selon les liquides et leur coefficient de solubilité, les gaz se dissolvent plus ou moins bien.
- La quantité de gaz dissout dépend pour un même gaz, de la nature du liquide et pour un même liquide , de la nature du gaz.
la température :
- Si la température augmente, les gaz se dilatent et leur quantité dissoute diminue.
- Il y a peu d'influence de la température sur la dissolution des gaz en plongée car celle-ci se situe au niveau des échanges gazeux et donc varie peu.
la surface d'échange :
Plus la surface de contact entre un gaz et un liquide est grande, plus la dissolution sera rapide pour un même volume de gaz a dissoudre : c'est le phénomène de diffusion.
La surface d'échange se situe au niveau des alvéoles pulmonaires.
La diffusion :
Capacité d'un gaz à pénétrer à l'intérieur d'un milieu où sa concentration y est plus faible.
le temps :
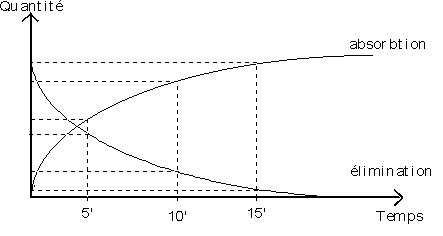 |
Plus longue sera la
durée, plus importante sera la quantité de gaz à se dissoudre, donc
sa tension
==> courbe exponentielle |
Autre loi sur la dissolution :
La quantité de gaz dissout à saturation dans un liquide dépend de la nature du gaz et du liquide, est lié de manière proportionnelle à la surface de contact, est lié de manière exponentielle au temps de contact et est lié de manière inverse à la notion de température.
V LES TISSUS ET LEUR PÉRIODE
Les tissus :
Afin d'étudier le mécanisme de dissolution de l'azote dans le corps humain, on fait appel à la notion de tissu ou compartiment
Le tissu ou compartiment est un liquide hypothétique censé représenter les propriétés moyennes des tissus anatomiques lors de la dissolution de l'azote dans le corps humain.
La période d'un tissu :
La période d'un tissu est le temps nécessaire à ce tissu pour absorber ou restituer la moitié de la quantité de gaz qu'il lui manque ou qu'il a en trop pour être à saturation.
VI COEFFICIENT DE SURSATURATION SC
Lorsqu'un plongeur remonte de plongée trop vite ou qu'il ne respecte pas les paliers de décompression, il a un accident de décompression
Cet accident se déclenche quand un tissu se trouve avec une sursaturation qui atteint en gros le double de la saturation normale à la profondeur où il se trouve. Le tissu en question a alors atteint son coefficient de sursaturation critique, ou l'a dépassé.
Le coefficient de sursaturation critique répond à la formule :
- SC = tension finale d'azote dans le tissu
- pression ambiante
- Exemple : Le tissu de période 7' a une saturation presque complète en 60 mn.
- Si on plonge 60 mn à 10 m => Pa = 2 bars
- => P = T = 2 bars
- Si on remonte rapidement, SC = T / P => SC = 2 / 1 => SC = 2
- Le coefficient SC pour le tissu de période 7' ne doit pas dépasser 2.54, donc pas de problème.
- Si on plonge 60 mn à 20 m => Pa = 3 bars
- => P = T = 3 bars
- Si on remonte rapidement, SC = T / P => SC = 3 / 1 => SC = 3
- SC pour le tissu de période 7' ne doit pas dépasser 2.54, donc il y a accident de décompression.
VII APPLICATIONS A LA PLONGÉE
| Dissolution des gaz dans les tissus | |
| Calcul des tables de plongées | |
| Traitement des accidents de décompression (médecine hyperbare) | |
| Prévention des accidents de décompression |
==> Respecter scrupuleusement les tables de plongée ainsi que la vitesse de remontée.